Grâce à son innovation, Ixaka donne une nouvelle dimension à l'immunothérapie
Nos articles Tech
En février dernier, alors que la pandémie occupait encore tous les esprits, Olivier Véran a annoncé que la France allait se doter pour la première fois d'une stratégie de lutte contre les cancers étalée sur dix ans. Dotée d'un budget renforcé à 1,74 milliards d'euros pour sa première feuille de route 2021-2025, cette stratégie ambitieuse sera coordonnée par l’Institut national du cancer. Parmi les différentes méthodes qui existent aujourd'hui pour traiter les cancers, l'immunothérapie consiste à stimuler et mobiliser le système immunitaire du patient pour qu'il élimine les cellules cancéreuses. C'est dans ce domaine qu'oeuvre Ixaka, une société issue du rapprochement de deux biotechs, l'une française, l'autre anglaise
Nous avons rencontré Renaud Vaillant, VP et Managing Director d'Ixaka France, afin qu'il nous parle de la technologie en jeu et des espoirs qui animent un champ de la recherche qui touche près de 4 millions de Français
Si l'on observe la carrière de Renaud Vaillant, le fil rouge semble être son goût d'entreprendre dans des secteurs de pointe. A 42 ans, ce Centralien - qui se décrit lui-même comme "chroniquement infecté par le virus de l'entrepreneuriat" - a déjà vécu trois grandes aventures entrepreneuriales. Après avoir fondé et dirigé pendant 7 ans Cryolog, une société fournissant des solutions de traçabilité de la chaîne du froid, il est contacté par l’un des fondateurs de la Biotech Theravectys, une spin-off de l'Institut Pasteur dans le domaine de la vaccination thérapeutique, pour en devenir le Directeur Général. Sa mission : accélérer le développement de candidats vaccins et ce faisant, la croissance de l'entreprise. Aux côtés de Cécile Bauche, la directrice scientifique de Theravectys, Renaud Vaillant développe une preuve de concept à partir de la technologie des vecteurs lentiviraux, puis valide un premier essai clinique. Les vecteurs lentiviraux, qui constituent le cœur de l'expertise du binôme Bauche-Vaillant, sont des virus génétiquement modifiés, dérivés du VIH, dont les mécanismes infectieux sont utilisés à des fins thérapeutiques. A la suite de ces premiers succès, l'équipe passe de 6 à 70 employés, et Theravectys ouvre sa plateforme à l'oncologie (la lutte contre le cancer).
Forts du savoir-faire recueilli sur les vecteurs lentiviraux et à la suite d'un changement d'actionnariat, Renaud Vaillant et Cécile Bauche quittent Theravectys en 2015 pour monter leur propre structure : aratinga.bio, racheté en juin 2020 par Rexgenero, qui deviendra Ixaka en janvier 2021. Sur quelle innovation repose leur technologie ?
Les cellules CAR-T : une découverte qui bouleverse la manière de lutter contre le cancer
Pour comprendre à quel point les résultats d'Ixaka sont porteurs d'espoir dans la lutte contre le cancer, il faut revenir en arrière et comprendre les différentes vagues d'innovation dans le domaine de l'immunothérapie. "Depuis qu'on comprend mieux l'immunologie, on sait que la réponse cellulaire du système immunitaire est en charge de l'élimination des cellules infectées ou des cellules cancéreuses", explique Renaud Vaillant. D'après ce dernier, le concept d'immunothérapie n'est pas nouveau ; comme nous l'évoquions en introduction, cette notion recouvre tout traitement qui ne s'attaque pas directement aux cellules cancéreuses mais qui cherche plutôt à stimuler la réponse immunitaire du patient pour l'aider à lutter par ses propres moyens contre ces mêmes cellules cancéreuses. "Pendant des années, on arrivait à guérir des souris grâce à l'immunothérapie, mais dès qu'on passait à l'être humain, les résultats étaient décevants", se souvient Renaud Vaillant.
Tout a changé lorsque deux technologies clés ont vu le jour, il y a une dizaine d'années. L'une de ces découvertes a trait aux "CAR-T Cells", ou cellules CAR-T. Une cellule CAR-T est un lymphocyte T - cellule chargée de l'immunité cellulaire - qui porte à sa surface un récepteur chimérique, c’est-à-dire qui a été créé en laboratoire. Ce récepteur est appelé CAR, pour "Chimeric Antigen Receptor" (Récepteur Antigénique Chimérique). "Les résultats cliniques obtenus avec cette technologie ont changé la vision de la communauté internationale scientifique sur le rôle des immunothérapies et des lymphocytes T", confie Renaud Vaillant, citant l'exemple très médiatisé d'Emily Whitehead, une petite fille de 6 ans atteinte de leucémie. Condamnée aux yeux de tous, elle a été le premier enfant à recevoir un traitement faisant appel à la technologie des cellules CAR-T en 2012. Les résultats ont été immédiatement probants, si bien qu'Emily est aujourd'hui considérée comme totalement guérie.
En quoi consiste précisément ce nouveau traitement ?
Comme l'explique Renaud Vaillant, la production des cellules CAR-T va de pair avec un cycle qui commence à l’hôpital, où les lymphocytes T du patient sont prélevés. On envoie ensuite l'échantillon à un laboratoire, dans le strict respect des standards BPF (pour "Bonnes Pratiques de Fabrication"), où les lymphocytes T sont isolés. C'est là que commence le travail de modification génétique : au moyen d'un vecteur de transfert de gène, souvent un vecteur lentiviral, les scientifiques modifient génétiquement les lymphocytes T afin de forcer l'expression d'un récepteur CAR à leur surface, comme l'illustre le schéma ci-dessous.

Or ce récepteur est spécifique des cellules cancéreuses que l'on veut éliminer chez le patient. Une fois l'opération accomplie, on fait proliférer les lymphocytes T modifiés afin de constituer une véritable "armée", avant de les réinjecter au patient au bout de trois semaines. Ainsi, une fois dans son organisme, les lymphocytes T modifiés vont être capables de reconnaître les cellules cancéreuses et de les éliminer plus efficacement.
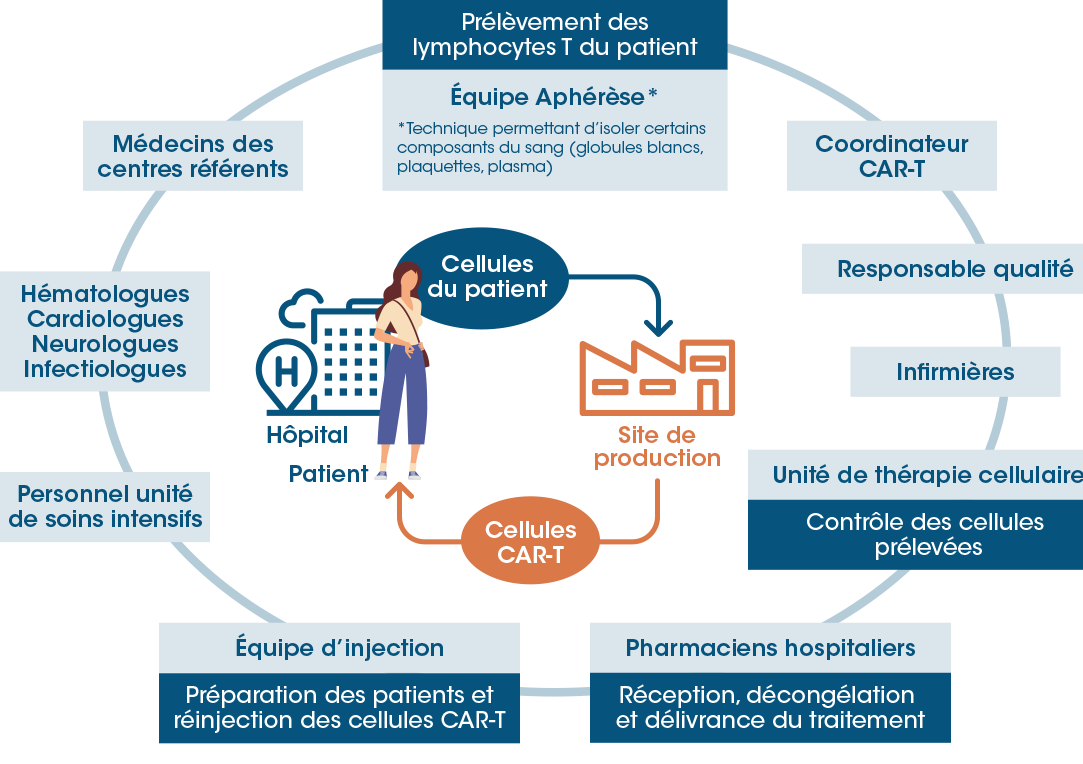
Les travaux d'Ixaka permettraient de réduire considérablement le coût du traitement
Si révolutionnaire que soit le traitement CAR-T, il est synonyme d'un processus complexe, comme l'illustre le schéma ci-dessus. Deux éléments de taille alourdissent son coût : le fait que ce soit un traitement personnalisé (on parle en effet de traitement "autologue", c'est-à-dire que seules les cellules du patient peuvent être traitées), et le fait que la manipulation génétique des cellules soit réalisée ex vivo. "Le coût du traitement, qui s'élève à 500 000 $ par patient pour une injection, constitue malheureusement un vrai frein à son développement commercial", regrette Renaud Vaillant.
Pour autant, les résultats cliniques sont spectaculaires, "avec un taux d'efficacité de 90% de réponse complète sur certaines indications", selon le fondateur d'aratinga.bio. De tels résultats ont poussé de nombreuses équipes dans le monde entier à travailler pour diminuer les coûts de fabrication attachés au traitement CAR-T. Parmi elles, les équipes d'aratinga.bio, devenue depuis Ixaka. "Notre stratégie se veut plus universelle", déclare Renaud Vaillant. "Nous proposons en effet d'injecter au patient en intraveineux le médicament, en l'occurrence le vecteur encapsulé dans un polymère ; la nanoparticule injectée permet de cibler et de modifier le lymphocyte T directement dans son organisme". Ainsi, le procédé mis au jour par Ixaka permet deux choses : d'une part, il supprime les étapes de modification génétique et la lourde logistique qui leur est associée ; d'autre part, il rend le traitement universel, en ce sens que la nanoparticule permet de traiter tous les patients atteints de la même maladie. "Le récepteur CAR est exprimé directement chez le patient qui devient en quelque sorte son propre incubateur", résume notre interlocuteur.
En plus de diminuer le coût du traitement par un facteur de 50 à 100, l'avantage de la technologie mise au point par Ixaka est qu'elle est immédiatement disponible pour un patient dont l'état de santé ne peut souvent pas lui permettre d'attendre. "Nous offrons un traitement "off-the-shelf", qui sera en principe plus efficace que les traitements ex-vivo puisque dans notre modèle, seuls les lymphocytes T efficaces vont proliférer", explique Renaud Vaillant. Au contraire, dans un traitement ex-vivo, on estime que 90% des clones réinjectés au patient vont mourir après l'injection". Enfin, les effets secondaires seraient moindres avec la technique in-vivo d'Ixaka.
Financer la préparation d'un essai clinique pour 2023
C'est en tout cas le prochain challenge pour les équipes R&D que de lutter contre les graves effets secondaires induits par ce nouveau type de thérapie. L'entreprise en est au stade préclinique : la preuve de concept a été établie chez l'animal, mais avant de préparer l'essai clinique, il faut réaliser des études toxicologiques pour évaluer l'inocuité (c'est-à-dire l'absence de toxicité) des produits développés. " L'essai clinique est prévu en 2023, car il faut prendre en compte le délai nécessaire pour obtenir les autorisations des agences règlementaires", dévoile Renaud Vaillant. L'évaluation de l'inocuité du traitement, ainsi que la production des lots de produits pour l'homme sont sous-traitées et réalisées dans des conditions sanitaires spécifiques - les Bonnes Pratiques de Laboratoires, qui respectent des standards de qualité internationaux.
Tout ceci a évidemment un coût conséquent. "Que ce soit dans le cadre d'aratinga.bio ou d'Ixaka, nous sommes des biotechs qui ne générons pas de revenus tant que le produit n'est pas allé au bout de son développement clinique", confie Renaud Vaillant. "Aussi nous appuyons-nous sur un financement forcément indirect". Le co-fondateur d'aratinga.bio énumère 4 grands types de financement : les partenariats avec les grands groupes pharmaceutiques ou avec les Biotechs, intéressés pour signer des accords de R&D ; les investissements qui prennent la forme d'augmentation de capital ; les subventions et avances remboursables ; le mécanisme du Crédit Impôt Recherche, particulièrement intéressant pour des sociétés où 80% des dépenses concernent de la R&D. En assurant le préfinancement du CIR, Neftys permet à Ixaka d'accélérer et d'assurer le financement du CIR "en temps réel". C'est en tout cas ce que déclare Renaud Vaillant, pour qui "Neftys permet de gagner 12 mois". "Tout cet argent financé en amont permet d'augmenter la création de valeur !" Au nom d'une noble cause : accélérer la recherche dans le domaine de la lutte contre le cancer du sang, qui constitue la priorité humaine et financière d'Ixaka.
À lire également
-

Nos articles Tech
ORME propulse l’analyse du mouvement, de l’automobile à l’aéronautique
Petite entreprise toulousaine d’une quinzaine de salariés, ORME réunit dans son portefeuille clients les plus grands noms de l'aéronautique, de l’automobile, des cosmétiques, des transports et de la Défense. Sa mission : apporter plus de fiabilité, de rapidité et de précision dans l’acquisition et le traitement d’images et de signaux.
-

Nos articles Tech
Handddle fait passer l’industrie manufacturière au 4.0 avec la puissance de l’IA
Présents à l’édition 2024 de VivaTech, nommés par Forbes en 2023 parmi les « 30 under 30 » qui « créent les produits, méthodes et matériaux de demain », Handddle est une jeune start-up bordelaise qui entend profiter des technologies d’intelligence artificielle pour rendre l’industrie manufacturière plus efficace, plus fiable, moins polluante et moins coûteuse.
-

Nos articles Tech
BioMeca aide l’industrie cosmétique et pharmaceutique à prouver l’efficacité de ses produits
La jeune entreprise de biotech lyonnaise BioMeca propose des services innovants basés sur la biomécanique pour caractériser et prouver l’efficacité des principes actifs et produits développés par les entreprises de cosmétique et de pharmaceutique.
En croissance annuelle de 5 %, le marché mondial des cosmétiques devrait dépasser d’ici 2031 les 600 milliards d’euros (selon une étude de Transparency Market Research). Bien que non limitée à ce marché prometteur, la cosmétique est le principal terrain d’étude de BioMeca, une entreprise lyonnaise fondée fin 2016 par Julien Chlasta à l’issue de son doctorat en morphogénèse des tissus.



